修復再生病理学丸山和晃講師他と東京大学の共同研究グループが新しいリンパ管の起源を発見しましたを掲載しました。
三重大学大学院医学系研究科修復再生病理学丸山和晃講師他と東京大学の共同研究グループが新しいリンパ管の起源を発見しました。
-
発表者
丸山 和晃 (三重大学大学院医学系研究科 修復再生病理学 学内講師、東京大学大学院医学系研究科 分子細胞生物学専攻 代謝生理化学分野 客員研究員)
富田-宮川 幸子 (ヤマザキ学園大学 教授)
今中-吉田 恭子 (三重大学大学院医学系研究科 修復再生病理学 教授)
栗原 裕基 (東京大学大学院医学系研究科 分子細胞生物学専攻 代謝生理化学分野 教授)
-
発表のポイント
・リンパ管の新しい起源を発見
・頭頸部・縦隔・心臓流出路領域のリンパ管内皮細胞・血管内皮細胞は心筋や顔面筋などと共通の起源から生じる
・ヒトリンパ管奇形・血管奇形が頭頸部や縦隔に好発する発生学的な基盤を解明
・リンパ管の進化発生にも新たな視点を提供
-
発表概要
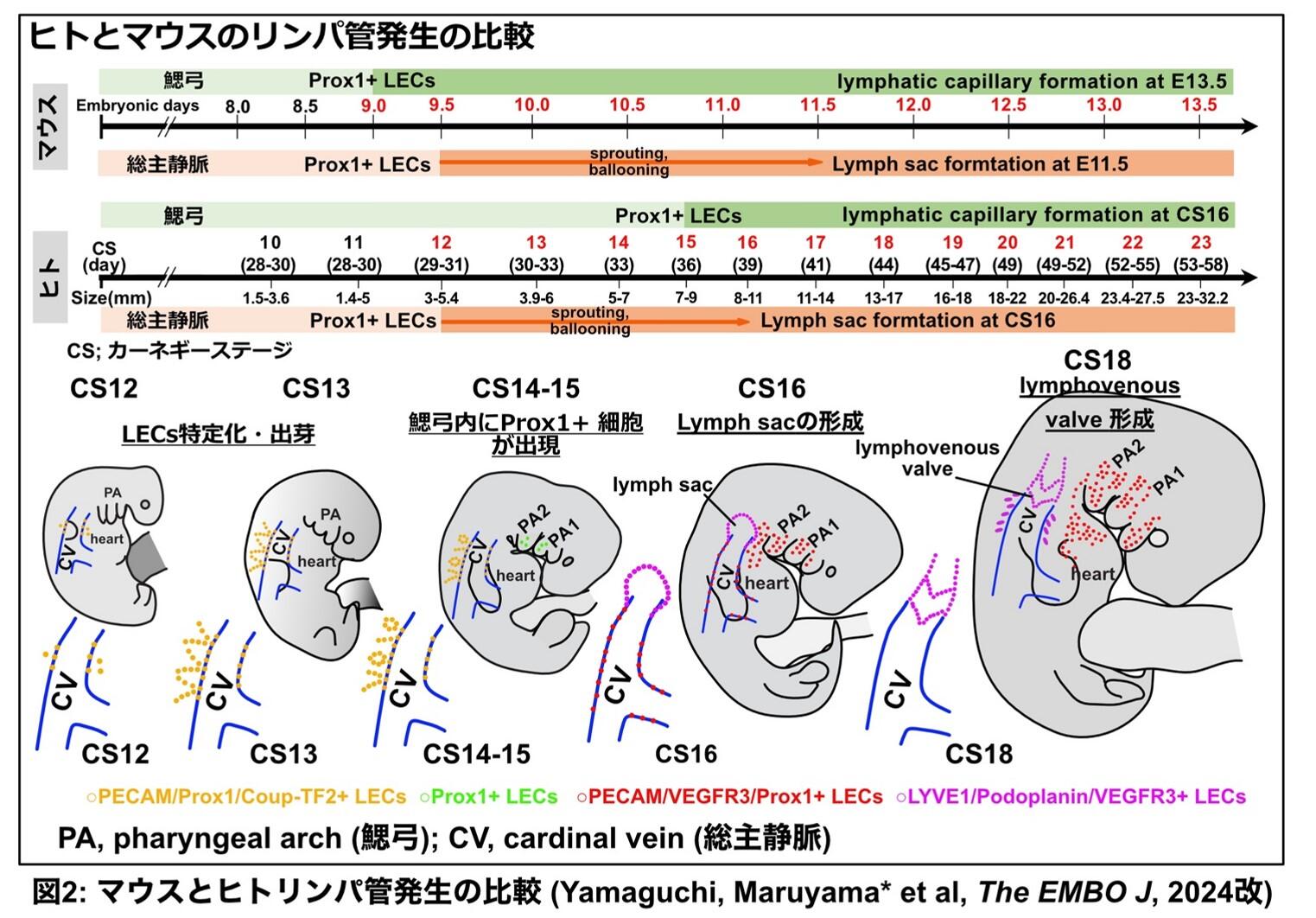
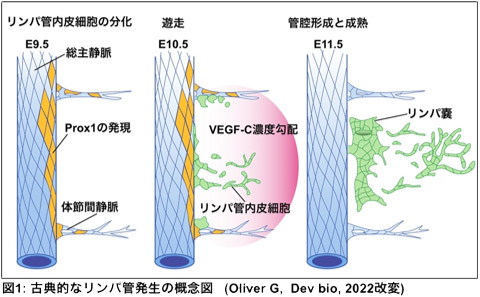
リンパ管は毛細血管から漏れ出た間質液や炎症反応が起きた際の炎症細胞の回収に重要な脈管です。さらに近年では心筋梗塞後の心室リモデリング(注1)や脳代謝産物の排出路としての役割もあることがわかってきています。このリンパ管がどのように形成されてくるのかは、およそ1世紀にもわたって議論が続いています。2000年代に入るとリンパ管内皮細胞に発現する特徴的な分子が次々と明らかになり、その知見を元に作成した遺伝子改変マウスを使用した実験により、胎生期に存在する総主静脈内皮細胞の分化転換によりリンパ管が形成されることがわかりました(添付図1)。これまでのリンパ管発生やリンパ管新生の分子機構研究は、この静脈からの分化転換により形成されるという知見を基盤に発展してきたものでした。
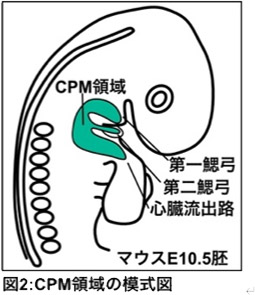
本論文で発表者は、遺伝子改変マウスを用いた実験より、近年頭頸部・心臓の筋肉や結合組織の起源として同定された心臓咽頭中胚葉 (Cardiopharyngeal mesoderm; CPM) (注2、添付図2)が、静脈系への分化を介さずに直接頭頸部・縦隔・心臓リンパ管や同領域の血管を形成することを明らかにしました。
頭頸部・縦隔は血管・リンパ管先天性疾患(注3)の好発部位として知られます。本研究により、これらの疾患がなぜ頭頸部や縦隔に生じるのか、発生学的な基盤が明らかになりました。またCPMは脊椎動物のみならず少なくとも尾索動物でも保存されていることから、リンパ管発生の進化的な側面を明らかにする可能性があります。
-
発表内容
<研究の背景>
リンパ系は魚類以降に出現し、進化の過程で役割を水分保持から脂質吸収・免疫へと複雑化させていったと考えられています。リンパ管障害は、リンパ浮腫が代表的ですが、心筋梗塞時の炎症反応調節、肥満、アルツハイマー病など、臓器や解剖学的部位に応じた病態生理学的役割があることがわかり始めています。しかし、リンパ管の生理学的役割や解剖学的な多様性がいかに獲得されるのかはよくわかっていません。リンパ管の系統発生に注目すると、ゼブラフィッシュイメージング解析で心臓と頭頸部のリンパ管は全身の静脈とは独立した起源を持つ事が示唆されていました。また、両生類、爬虫類、鳥類胎生期には横紋筋構造を有するリンパ心臓がリンパ循環を補助しています。さらにリンパ管発生のマスターレギュレーターである転写因子Prox1は心筋発生にも重要です。したがって、発表者は心臓発生と心臓・頭頸部のリンパ管発生には生物種を超えて保存された関連性があると予想しました。
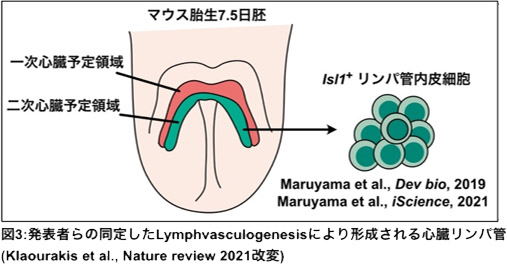
発表者は、マウス心臓リンパ管が心臓前駆細胞(注4)の分化転換により形成される事を報告し、心臓では総主静脈の他にもリンパ管内皮細胞の起源があることを明らかにしていました 。他にも発表者らは皮膚・心臓リンパ管発生を制御する分子シグナルとしてSemaphorin3E-PlexinD1シグナルを報告していました(添付図3)。一方、心臓リンパ管がなぜ独自の発生過程を経るのかその生物学的な意義は解決すべき課題として残されていました。
心臓と頭頸部骨格筋は共通起源を持つ
心臓は生命維持に必須の重要な臓器の一つであり、独自の進化を経て形成されたと考えられてきました。しかし近年のニワトリ・マウス胚を用いた細胞系譜追跡により心臓と頭頸部骨格筋や結合組織の共通前駆細胞が明らかになりました。この知見は先天性心疾患と先天性顎顔面疾患が併発する(DiGeorge症候群)原因を明らかにし、遺伝子変異(Tbx1)同定にも大きな役割を果たしました。心臓と顎顔面の共通の前駆細胞は心臓咽頭中胚葉 (Cardio-Pharyngeal Mesoderm; CPM)と呼ばれ、鰓弓中胚葉領域や心臓流出路に分布します(添付図2)。CPMにはIsl1を含む心臓前駆細胞に特徴的な遺伝子が発現し、さらに尾索動物であるホヤでもこのCPMが顔面筋(水管筋)と心臓に寄与することや、心臓を持たない線虫でも顔面筋が心臓発生に必須の遺伝子を発現していることがわかり、CPMは広く種間でも保存された心臓・頭頸部の共通前駆細胞群であると考えられるようになりました。
<研究の内容>
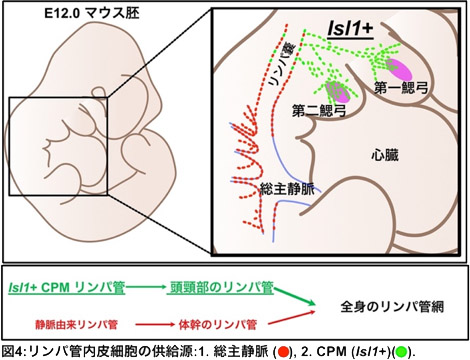
発表者はこれらの背景に基づき、CPM細胞を標識する様々な遺伝子改変マウス(Isl1-Cre, Isl1-CreERT2など)を使用し、CPM細胞から生じるリンパ管内皮細胞の分布を解析しました。その結果、頭頸部・縦隔・心臓流出路にかけてはこれまでのセオリーに反し、頭頸部・心臓筋肉の起源であるCPMよりリンパ管が形成されている事を明らかにしました(図4)。また、同領域の血管内皮細胞もCPMに由来することが明らかになりました。
<社会的意義>
本研究により、これまで単一の起源により生じると考えられてきたリンパ管の新しい起源が明らかになりました。また、本研究成果により、頭頸部や縦隔領域に限局して発生する事が多い難治性疾患であるリンパ管・血管の先天性疾患(リンパ管・血管奇形)の発生学的な基盤が明らかになりました。また、CPMは脊椎動物で共通した前駆細胞である事から、リンパ管がどのように獲得され、その生理学な役割を水分保持・脂質吸収から免疫まで拡大させていったのか、その進化的な側面が明らかになる可能性があります。
本研究は国立研究開発法人科学技術振興機構(JST) 戦略的創造研究推進事業CREST「細胞動態の多様性・不均一性に基づく組織構築原理の解明」(研究総括:栗原裕基), 日本学術振興会 科学研究費助成事業 基盤研究A「多種細胞連環に基づく冠循環系の発生・進化・病態・再生の統合的理解」、基盤研究S「発生学的共通基盤に立脚した心臓疾患および縦隔疾患の統合的病態理解」(代表:栗原裕基)および科学研究費助成事業 若手研究「臓器特異的リンパ管発生機構の解明」(代表:丸山和晃)、公益財団法人 武田科学振興財団 医学系研究助成「発生学的解析に基づくリンパ管奇形の病因解明・新規治療法開発」(代表:丸山和晃)などに基づく研究として行われました。
-
発表雑誌
雑誌名:「eLife」(英国時間 10月 4日:オンライン版)
論文タイトル: The cardiopharyngeal mesoderm contributes to lymphatic vessel development in mouse
著者: Kazuaki Maruyama*, Sachiko Miyagawa-Tomita, Yuka Haneda, Mayuko Kida, Fumio Matsuzaki, Kyoko Imanaka-Yoshida, and Hiroki Kurihara* * (*責任著者)
DOI 番号: 10.7554/eLife.81515
-
問い合わせ先
三重大学大学院医学系研究科 修復再生病理学 学内講師
東京大学大学院医学系研究科 分子細胞生物学専攻 代謝生理化学 客員研究員
丸山 和晃(まるやま かずあき) Tel:03-5841-3498、Fax:03-5841-3603 E-mail: k.maruyama0608@gmail.com
教授 栗原 裕基(くりはら ひろき) Tel:03-5841-3498、Fax:03-5841-3603 E-mail: kuri-tky@umin.net
用語解説
(注1)心室リモデリング: 心臓が血行力学的負荷に対応して循環動態を一定に保つために構造と形態を変化させること。心筋梗塞後では心筋壊死部が瘢痕組織に置き換わること。
(注2)心臓咽頭中胚葉(Cardiopharyngeal mesoderm; CPM): 近年新たに定義された中胚葉領域。側板中胚葉や沿軸中胚葉が咽頭胚期(発生の特定の時期)に咽頭中胚葉で混ざり合い形成される。この中胚葉領域に異常が起こると顔面と心臓の先天性疾患(例えばDiGeorge症候群)が起こると考えられている。
(注3) 血管・リンパ管先天性疾患:例えば特定難治性疾患の巨大リンパ管奇形(頸部顔面病変、指定難病279)、巨大静脈奇形(頸部顔面病変、指定難病280)など
(注4)心臓前駆細胞:心臓は一次心臓予定領域細胞や、二時心臓予定領域細胞、心外膜前駆組織、神経堤細胞などの細胞から構成される。一次、二次心臓予定領域細胞はCPM細胞と部分的に共通する事が明らかになっている。
添付資料
|
|
図1: 古典的なリンパ管発生の模式図。リンパ管内皮細胞は総主静脈内皮細胞にリンパ管発生に必須の転写因子Prox1が発現する事で生じる。 |
|
|
図2:CPM領域の模式図。CPMは咽頭弓の中胚葉領域に位置する。 |
|
|
図3:発表者らの同定したLymphvasculogenesisにより形成される心臓リンパ管。発表者らはこれまでに心臓リンパ管がIsl1+の心臓前駆細胞から生じる事や心臓リンパ管発生がSemaphorin3E-PlexinD1シグナルにより制御されることを明らかにしていた。 |
|
|
図4:発表者らの同定したリンパ管の起源。 リンパ管は大きく総主静脈とCPMという2つの起源を持つことが明らかになった。 |